Alles over tumoren
Gliomen
De steuncellen die het zenuwweefsel voeden, beschermen, isoleren, en op hun plek houden, heten glia-cellen. De tumoren die uit deze steuncellen voortkomen heten gliomen. Per jaar wordt in Nederland bij iets meer dan 1.000 mensen een glioom geconstateerd. Dit is meer dan de helft van het totaal aantal primaire hersentumoren.
Onder de microcoop zijn meerdere soorten glia-cellen te onderscheiden:
- Astrocyten
- Oligodendrocyten
- Ependymcellen
- Microglia
Uit ieder celtype kan een glioom ontstaan; vaak kan de patholoog nog onderscheiden uit welke gliacel de tumor is ontstaan.
 Beelden van enkele verschillende gliomen zoals ze er na kleuring onder de microscoop uit zien.
Beelden van enkele verschillende gliomen zoals ze er na kleuring onder de microscoop uit zien.
Astrocyten zijn kleine stervormige cellen (het Latijnse woord aster betekent ster). De meeste gliomen ontstaan uit astrocyten en heten astrocytomen. Een kleiner deel van de gliomen ontstaan uit oligodendrocyten, de cellen die de ‘isoleerlaag’ rond zenuwbanen vormen; deze tumoren worden oligodendrogliomen genoemd. Een tumor met een combinatie van beide soorten cellen heet meng-glioom of oligo-astrocytoom.
Ependymomen komen voort uit de ependymcellen, de cellen die de wand van de hersenkamers bekleden. Ze komen dan ook vooral in en bij de hersenkamers voor en zijn relatief zeldzaam.
Kwaadaardigheid en graad van een tumor
De kwaadaardigheid van de tumor valt te beoordelen aan de hand van een aantal kenmerken: Hoeveel cellen delen zich? Hoeveel bloedvaten zitten er in de tumor en hoe zien die bloedvaten eruit (grillig of normaal)? Zitten er veel afgestorven cellen in de tumor? Welke soort gliacellen overheerst? Op basis van deze kenmerken kunnen gliomen worden ingedeeld in:
-
laaggradige tumoren (graad 1 en 2)
- hooggradige tumoren (graad 3 en 4)
‘Laaggradig’ en ‘hooggradig’ staan niet gelijk aan ‘goedaardig’ en ‘kwaadaardig’. Van de gliomen zijn alleen de graad 1 tumoren, het pilocytair en pilomyxoid astrocytoom, echt goedaardig: deze tumoren groeien plaatselijk en zijn met een volledige operatie vaak te genezen. De andere gliomen (graad 2, 3 en 4) gedragen zich uiteindelijk kwaadaardig – hoe hoger de graad, hoe kwaadaardiger – en komen vrijwel altijd terug. Daarbij krijgen graad 2 en 3 tumoren tijdens hun ontwikkeling uiteindelijk meestal een hogere graad. Het glioblastoom (GBM), vroeger 'glioblastoma multiforme' genoemd, is de meest kwaadaardige (graad 4) en helaas ook de meest voorkomende vorm.
Wanneer bij een hersentumor gesproken wordt van kwaadaardigheid, dient men zich te realiseren dat dit een ander soort kwaadaardigheid is dan wordt bedoeld bij andere soorten kanker in het lichaam: een glioom zaait vrijwel nooit uit buiten het zenuwstelsel, maar groeit diffuus in het omliggende hersenweefsel in. We spreken dan van infiltratieve groei. Dat maakt dat een glioom eigenlijk nooit radicaal door de chirurg kan worden verwijderd: de tumorcellen zijn al ver in het hersenweefsel doorgedrongen en er is geen duidelijke scheiding tussen tumorwefsel en hersenweefsel. De kwaadaardigheid zit hem in het feit dat een glioom bijna altijd weer terugkomt (een hele enkele uitzondering daargelaten).
Moleculaire veranderingen (moleculaire markers)
De gradering van een glioom zegt niet altijd alles over hoe een tumor zich ontwikkelt bij een individuele patiënt. Dat betekent dat een tumor met een hogere graad soms minder snel terug komt dan je op grond van het microscopisch beeld zou verwachten.
Het type glioom is van belang: zo hebben de pure oligodendrogliomen over het algemeen een gunstiger prognose dan de astrocytomen. Oligodendrogliomen zijn meestal gevoeliger voor behandelingen zoals chemotherapie dan astrocytomen. Meng-gliomen hebben een prognose en gevoeligheid voor behandeling die tussen het astrocytoom en het oligodendroglioom in zit.
De laatste jaren wordt steeds duidelijker dat niet alleen het type glioom (celtype) van belang is. Ook de moleculaire kenmerken van de tumor zeggen veel over de prognose. Met ‘moleculaire kenmerken’ worden de eigenschappen van het tumorweefsel en van het DNA (erfelijk materiaal) van de tumor bedoeld. Soms zeggen deze kenmerken ook iets over de gevoeligheid voor therapie.
Enkele belangrijke moleculaire kenmerken (‘markers’) van gliomen zijn de volgende:
- De 1p/19q-codeletie is een kenmerk dat vooral bij oligodendrogliomen en menggliomen (graad 2 en 3) voorkomt. Iedere menselijke cel bevat 23 paar chromosomen, die genummerd zijn van 1 tot en met 22, plus 1 paar geslachtschromosomen (X en Y). Ieder chromosoom bevat 2 korte armen (p-armen) en 2 lange armen (q-armen). Indien er bij het chromosomaal onderzoek van een glioom sprake is van verlies van de korte arm van chromosoom 1 (1p) en de lange arm van chromosoom 19 (19q) is dat voor de prognose gunstig. Patiënten met een 1p/19q-codeletie hebben dus een betere prognose dan andere glioom-patiënten en zijn bovendien vaak gevoeliger voor behandelingen, vooral voor chemotherapie. Als er geen co-deletie is, spreek je van een ‘1p/19q-intacte tumor’. Dat laatste is dus een ongunstige kwalificatie!
- De MGMT-methylatie is een eigenschap die iets zegt over de prognose van glioblastomen (graad 4) en over de gevoeligheid voor chemotherapie. MGMT staat voor O-6-methylguanine-DNA-methyltransferase. Een afwijkende (‘gemethyleerde’) MGMT-status is gunstig omdat normaal MGMT de gevoeligheid voor chemotherapie vermindert.
- IDH1 en IDH2 (isocitraat dehydrogenase 1 en 2) zeggen iets over de prognose van verschillende graden gliomen. Bij een diffuus glioom, van graad 2, 3 of 4, is een afwijking hierin (‘IDH-mutant’) meestal gunstiger dan wanneer er geen afwijking is (‘IDH-wildtype’).
- Homozygoot verlies van CDKN2A/B (HD-CDKN2A/B) komt voor bij verschillende soorten gliomen. Het is een ongunstig prognostisch teken: tumoren met HD-CDKN2A/B gaan in het algemeen gepaard met een slechtere prognose dan tumoren die dit niet hebben.
Deze ‘markers’ zijn dus van belang om een diagnose beter te stellen. Ook kunnen ze iets zeggen over de prognose (‘prognostische markers’). Tenslotte kunnen ze iets zeggen over de gevoeligheid van de tumor voor behandeling; het kijken naar de marker kan dan helpen in de keuze van de behandeling (‘predictieve markers’).
Indeling van hersentumoren
Sinds 2016 heeft de wereldgezondheidsorganisatie (WHO) een nieuwe indeling van gliomen gemaakt. Hierin worden het soort cellen, de graad en de moleculaire markers gecombineerd. Samen vormt dit een ‘gelaagde’ diagnose.
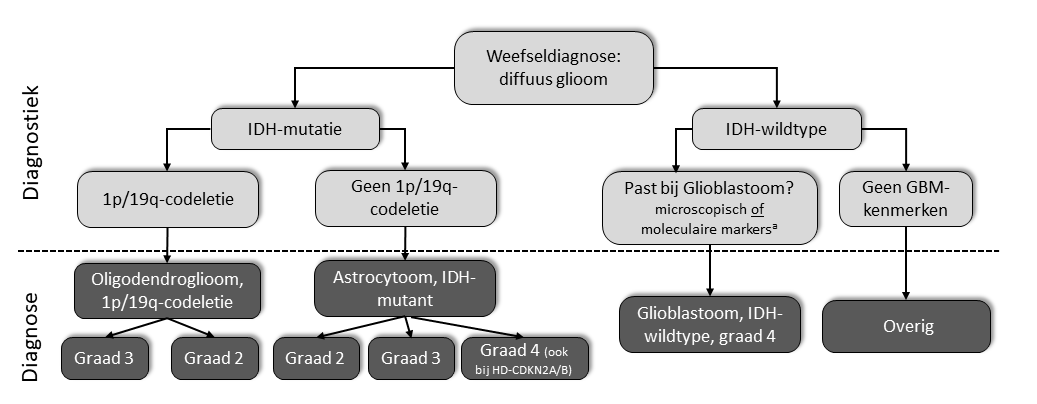
Indeling van diffuse gliomen volgens de WHO (versie 5, uit 2021).
Lees hieronder meer over de verschillende soorten gliomen:
Onderverdeling tumoren
Glioom graad 2 (laaggradig glioom)
Symptomen
- Epileptische aanvallen (insulten) zijn meestal het eerste symptoom
- (Subtiele) gedragsverandering en stemmingsstoornissen
- Soms zijn er geen klachten en wordt de tumor toevallig ontdekt, wanneer er een scan om een andere reden gemaakt wordt.
De volgende symptomen komen minder vaak voor, omdat een laaggradig glioom meestal langzaam groeit en dus weinig druk en weinig schade aan het hersenweefsel geeft:
- Veranderingen in het denken, onthouden en gedrag
- Neurologische uitval, zoals zwakte of verlamming in een lichaamshelft, stoornissen van het zien en problemen van taal en spraak.
- Hoofdpijn
Diagnose
Het laaggradig glioom is een langzaam groeiende tumor, meestal bij volwassenen tussen de 20 en 50 jaar. Op een MRI gaat het meestal om een vaag begrensde tumor die geen contrastmiddel opneemt.
Onderzoek van het weefsel is nodig om de diagnose te bevestigen. Bij weefselonderzoek kan ook het type glioom worden vastgesteld:
- Laaggradig astrocytoom
- Laaggradig oligodendroglioom
De oligodendrogliomen hebben gemiddeld een betere prognose dan de astrocytomen. Voor de prognose zijn ook de moleculaire kenmerken van belang:
- deze tumoren hebben een IDH-mutatie (IDH1 of IDH2). Tumoren met een IDH-mutatie hebben een aanzienlijk betere prognose dan tumoren zonder mutatie (ook wel ‘IDH-wildtype’ genoemd).
- de 1p/19q-codeletie komt vooral bij oligodendrogliomen voor.
Deze hebben een relatief goede prognose en reageren meestal langdurig op behandeling, onder meer met PCV chemotherapie
Kwaadaardig of niet?
Een graad 2 glioom, zoals dat bij volwassenen voorkomt, groeit in de regel langzaam en geeft daarbij weinig of geen neurologische uitval. ‘Laaggradig’ betekent echter niet dat de tumor ook goedaardig is. Helaas ontwikkelt een laaggradig glioom (graad 2) zich in de loop der tijd vrijwel altijd tot een meer kwaadaardig glioom (graad 3/4).
Behandeling
De noodzaak tot behandeling hangt sterk af van de ernst van de klachten, de grootte van de tumor en de lokalisatie van de tumor in de hersenen.
Het verwijderen (resectie) van de tumor kan de klachten verbeteren, maar het is zelden mogelijk om de tumor volledig te verwijderen. Het vroeg opereren – zodra de tumor ontdekt wordt – zorgt mogelijk voor verbetering van de levensverwachting. Omdat een operatie ook risico’s geeft op neurologische uitval (zie Neurochirurgie), moeten de voor- en nadelen van een operatie altijd goed afgewogen worden.
Na een operatie waarbij een groot deel van de tumor is weggenomen, is aanvullende behandeling niet altijd direct nodig.
Aanvullende behandeling – dus een andere behandeling dan een operatie – kan nodig zijn wanneer:
- een tumor weer groeit na een eerdere operatie
- een tumor tekenen vertoont van meer agressieve (hooggradige) groei
- een operatie niet mogelijk is, of slechts beperkt mogelijk, en er toch een noodzaak voor behandeling is.
Als er aanvullend behandeld wordt, was radiotherapie lang de meest gebruikte optie. Recente onderzoeken wijzen erop dat sommige patiënten met een laaggradig glioom kunnen profiteren van radiotherapie, direct gevolgd door chemotherapie. De keuze voor de soort chemotherapie hangt af van tumorsoort en moleculaire markers.
In 2023 is gebleken dat het medicijn vorasidenib (filmpje, in Engels) effectief is bij het remmen van tumorgroei van een laaggradig glioom, na operatie en voordat er bestraling of chemotherapie is gegeven. Vorasidenib is een vorm van doelgerichte therapie. In Nederland wordt nu (mei 2025) bekeken of dit medicijn beschikbaar komt op de Nederlandse markt. Sommige patiënten worden via een tijdelijk programma reeds behandeld.
laatst bijgewerkt 22 mei 2025
Hooggradig glioom met IDH-mutatie (graad 3 of 4)
Symptomen
Net als bij laaggradige gliomen met een IDH-mutatie kunnen hooggradige gliomen met een IDH-mutatie zich presenteren met epileptische aanvallen of gedragsveranderingen. Uitvalsverschijnselen staan echter meer op de voorgrond door de meer agressieve groei.
- Verlammingsverschijnselen, in het bijzonder zwakte van een lichaamshelft
- Problemen van de spraak en taal: het articuleren of het vinden van de woorden
- Stoornissen van het gezichtsvermogen, in het bijzonder uitval van een helft van het gezichtsveld: botsen tegen de deurpost, verwaarlozing van een helft van het lichaam
- Veranderingen in het denken, onthouden en gedrag
- Hoofdpijn, misselijkheid en braken
- Gevoelsuitval
Diagnose
Een hooggradig glioom, IDH-mutant (graad 3 of 4) groeit onbehandeld vaak snel door in het omliggende hersenweefsel; de ziektegeschiedenis is daarom meestal relatief kort. De meeste patiënten zijn tussen de 30 en 50 jaar oud bij graad 3, en vaak ouder dan 55 bij graad 4, iets vaker mannen dan vrouwen. Een MRI toont meestal een grillige, slecht begrensde tumor die met contrast kan aankleuren. De diagnose moet gesteld worden door onderzoek van het weefsel. Bij weefselonderzoek kan ook het type glioom worden vastgesteld:
- Oligodendroglioom, IDH-mutatie en 1p/19q-codeletie, graad 3
- Astrocytoom, IDH-mutatie, graad 3
- Astrocytoom, IDH-mutatie, graad 4
Net als bij de laaggradige gliomen, hebben de oligodendrogliomen gemiddeld een betere prognose dan de astrocytomen, en graad 3 een betere prognose dan graad 4. Voor de prognose zijn de moleculaire kenmerken van belang:
- deze tumoren hebben een IDH-mutatie (IDH1 of IDH2). Tumoren met een IDH-mutatie hebben een aanzienlijk betere prognose dan tumoren zonder mutatie (ook wel ‘IDH-wildtype’ genoemd).
- de 1p/19q-codeletie komt vooral bij oligodendrogliomen voor.
Deze hebben een relatief goede prognose en reageren meestal langdurig op behandeling, onder meer met PCV chemotherapie
Behandeling
De behandeling hangt vooral af van de algemene conditie van de patiënt, de omvang van de tumor en de plaats in de hersenen. De behandeling begint in het algemeen met een operatie: indien mogelijk wordt zoveel mogelijk tumorweefsel weggehaald. Als dit niet mogelijk is, volgt in ieder geval een biopt om de diagnose zeker te stellen.
Operatie alleen is zelden voldoende bij een anaplastisch glioom. De nabehandeling kan bestaan uit radiotherapie, chemotherapie of een combinatie van beide. Op basis van recente onderzoeken wordt tegenwoordig meestal gekozen voor een combinatie van radiotherapie en chemotherapie:
- Radiotherapie, gevolgd door PCV chemotherapie; dit is de meestgekozen behandelingen bij oligodendrogliomen met een 1p/19q-codeletie);
- Radiotherapie, gevolgd door temozolomide chemotherapie; bij hooggradige gliomen met IDH-mutatie en zonder 1p/19q-codeletie;
- Radiotherapie gecombineerd met temozolomide, en nadien temozolomide kuren; deze combinatietherapie wordt vooral toegepast bij tumoren met agressieve kenmerken, zoals afwezigheid van een IDH-mutatie (‘IDH-wildtype’).
Er is geen standaardbehandeling als de tumor terugkomt. Opnieuw zal worden bekeken wat mogelijk is. Alle bovengenoemde behandelingen kunnen hierbij weer overwogen worden. Bovendien zijn er regelmatig experimentele behandelingen die in studieverband worden gegeven.
Glioblastoom (graad 4)
Het glioblastoom (GBM) – ook wel aangeduid met de (verouderde) naam glioblastoma multiforme – is het meest voorkomende en helaas ook meest agressieve glioom, en komt vooral voor op hogere leeftijd tussen de 50 en 70 jaar. Het komt iets vaker voor bij mannen dan bij vrouwen.
Symptomen
Het glioblastoom groeit snel en geeft veelal in korte tijd (meestal enkele weken tot maanden) ernstige klachten:
- Hoofdpijn, misselijkheid, braken
- Epileptisch insult
- Verlammingsverschijnselen, in het bijzonder zwakte van een lichaamshelft
- Problemen van de spraak en taal: het articuleren of het vinden van de woorden
- Stoornissen van het gezichtsvermogen, in het bijzonder uitval van een helft van het gezichtsveld: botsen tegen de deurpost, verwaarlozing van een helft van het lichaam
- Veranderingen in het denken, onthouden en gedrag.
- Gevoelsuitval
Diagnose
De symptomen zijn vaak zo ernstig dat een patiënt snel wordt verwezen naar een neuroloog. Het kenmerkende beeld van een glioblastoom op een MRI is een grillige hersentumor, waarbij de randen veel contrast opnemen en het centrum van de tumor weinig contrast opneemt (= dood weefsel). De diagnose moet gesteld worden middels weefselonderzoek.
Bij een glioblastoom zijn er in het weefsel verschillende varianten te onderscheiden. Ook zijn er soms moleculaire veranderingen die iets zeggen over de prognose (zie Soorten gliomen en moleculaire veranderingen). Voor de meeste patiënten hebben al deze varianten en moleculaire veranderingen op dit moment echter meestal geen invloed op de keuze van de behandeling.
Behandeling
De behandeling begint in het algemeen met een operatie: indien mogelijk wordt zoveel mogelijk tumorweefsel weggehaald. Als dit niet mogelijk is, volgt in ieder geval een biopt om de diagnose zeker te stellen.
Operatie alleen is nooit voldoende bij een glioblastoom. De nabehandeling is vooral afhankelijk van iemands algemene conditie en leeftijd. De standaard-opties zijn:
- Radiotherapie in combinatie met temozolomide chemotherapie. Deze behandeling wordt ook wel chemoradiatie of het Stupp-schema (spreek uit: Sjtoep-schema) genoemd. Deze behandeling bestaat uit zes weken van bestraling, meestal vijf dagen per week, en chemotherapie in capsulevorm, zeven dagen per week. Daarna volgt een periode met losse kuren chemotherapie (vaak zes kuren), meestal vijf dagen chemotherapie per vier weken. Chemoradiatie is de standaardbehandeling bij patiënten die in goede conditie zijn. Ook leeftijd speelt een rol; de behandeling wordt het meest toegepast bij patiënten onder de 65-70 jaar.
- Er bestaat ook een ingekorte variant van chemoradiatie, met in het begin 3 weken bestraling (15 keer) in plaats van 5 weken. Hierop volgen zes tot twaalf kuren chemotherapie. Deze variant kan bij oudere patiënten in een relatief goede conditie worden toegepast.
- Radiotherapie. Meestal gaat het om een relatief kort schema: drie weken lang, vier dagen per week, bestraling. Bij patiënten in een minder goede conditie, en bij oudere patiënten, is alleen radiotherapie vaak de eerste keuze.
- Temozolomide chemotherapie. Bij een groep (vaak oudere) patiënten zal in plaats van alleen radiotherapie gekozen worden voor alleen chemotherapie. Bij deze keuze spelen moleculaire veranderingen in de tumor een rol: bij de aanwezigheid van een MGMT-methylatie is chemotherapie vaak effectiever alleen dan radiotherapie alleen. Het gaat dan om een aantal kuren chemotherapie in capsulevorm.
Er is geen standaardbehandeling voor glioblastomen die terugkeren. Van alle beschikbare behandelingen is de kans van slagen onzeker. Opnieuw behandelen met operatie, radiotherapie of chemotherapie is bij sommige patiënten zinvol. Ook worden soms andere vormen van chemotherapie gegeven. Daarnaast zijn er regelmatig experimentele behandelingen die in studieverband worden gegeven.
laatst bijgewerkt 14 oktober 2024
Hersenstamglioom
Een glioom in de hersenstam komt vooral voor bij kinderen tussen de drie en tien jaar.
Symptomen
Als het hersenvocht niet goed langs de tumor kan stromen, dan treden klachten op van misselijkheid, braken en hoofdpijn. Vaak zijn dit de eerste symptomen die optreden bij een hersenstamglioom. Veel hersenstamgliomen zijn langzaam groeiend en geven zeker in het begin nogal eens vage klachten. Ook de jonge leeftijd van de patiënten, die moeilijk hun klachten onder woorden kunnen brengen, draagt bij aan de moeilijke diagnose. Pas later ontstaan klachten die leiden tot een juiste diagnose:
- Moeite met praten en evenwichtsstoornissen
- Slikmoeilijkheden
- Dubbelbeelden of scheel kijken
- Zwakte van de gelaatsspieren
- Krachtverlies of gevoelsverlies in de armen en/of benen
Diagnose
De diagnose berust vooral op de afbeelding van de tumor op een MRI. In tegenstelling tot overige gliomen is weefselonderzoek vaak niet mogelijk, uit gevaar voor beschadiging van hersencentra die van levensbelang zijn (ademhaling en slikken). Een zogenaamde stereotactische biopsie kan soms worden verricht. Naast microscopisch onderzoek kunnen moleculaire markers in het tumorweefsel helpen bij de diagnose:
- tumoren in de middelste structuren van de hersenen heten 'diffuus midlijn glioom' (DMG) en hebben een H3K27-mutatie.
- tumoren in de hersenhelften van de hersenen heten 'hemisferisch glioom' en hebben een H3G34-mutatie.
Behandeling
Een operatie om de tumor te verwijderen is meestal te gevaarlijk. Radiotherapie kan de klachten verminderen en kan de groei van de tumor remmen. Er is geen standaardbehandeling voor tumoren als ze terugkomen. Chemotherapie lijkt van weinig waarde bij deze tumoren.Hydrocephalus (een waterhoofd) treedt geregeld op bij hersenstamgliomen. Dit kan worden behandeld met een kijkoperatie waarbij een gaatje wordt gemaakt in de bodem van de derde hersenkamer, of met een shunt (waarbij hersenvocht wordt afgeleid naar de buik of naar het hart).
laatst bijgewerkt 14 oktober 2024
Ependymoom
De hersenholtes (ventrikels) en hersenkanalen, waarin hersenvocht (liquor) stroomt, worden bedekt met ependymcellen. Gliomen die ontstaan uit de ependymcellen worden ependymomen genoemd. Ependymomen kunnen zowel in de grote hersenen, de kleine hersenen, als in het ruggenmerg voorkomen. Ependymomen kunnen in tegenstelling tot de andere gliomen wel uitzaaien: Omdat het ependymoom in het hersenvocht groeit kunnen tumorcellen met het hersenvocht verplaatsen en zo uitzaaiingen in hersenen of ruggenmerg veroorzaken. Uitzaaiingen naar elders in het lichaam komen voor, maar zijn zeldzaam.
Symptomen
Omdat ependymomen in de hersenholtes groeien, kunnen ze aanleiding geven tot een opstopping van de stroom van het hersenvocht. Bij heel jonge kinderen kan dat aanleiding geven tot een hydrocephalus (waterhoofd). Bij oudere kinderen en bij volwassenen geeft dat aanleiding tot:
- Hoofdpijn, misselijkheid en braken
- Spraak- en evenwichtsstoornissen
- Slikmoeilijkheden
- Krachtsverlies of gevoelsvermindering van armen en/of benen
- Krachtsverlies in het gelaat
- Dubbelbeelden
Diagnose
Een MRI toont veelal een tumor nabij de hersenholtes met vergroting van de hersenholtes (hydrocephalus). Een MRI wordt gemaakt van zowel de hersenen als van de wervelkolom om na te gaan of er geen andere tumoren zijn in de hersenen en het ruggenmerg.
Behandeling
De behandeling bestaat uit operatie, soms gevolgd door radiotherapie. De vergrote hersenholtes kunnen zo nodig operatief worden ontlast door middel van een shunt. In geval van een terugkerend ependymoom kan ook chemotherapie worden overwogen.
laatst bijgewerkt 9 september 2019
Opticus glioom
Het glioom van de oogzenuw (opticus glioom) komt op alle leeftijden voor, maar meestal bij kinderen. Een op de drie patiënten met een opticus glioom heeft ook de ziekte van Recklinghausen (neurofibromatose type I = NF1), en andersom: ongeveer een op de zes patiënten met NF1 ontwikkelt een opticus glioom. Er wordt gezegd dat patiënten met NF1 een betere prognose hebben dan de patiënten met een toevallig ontdekt opticus glioom.
Symptomen
- Gezichtsveldverlies is het belangrijkste probleem van het opticus glioom.
- Grotere tumoren kunnen gepaard gaan met hormonale stoornissen, zenuwuitval, en belemmering van afvloed van hersenvocht ( hydrocephalus).
Diagnose
De diagnose opticus glioom wordt meestal gesteld met een MRI.
Behandeling
Bij grotere tumoren, die het gezichtvermogen bedreigen, moet een operatie overwogen worden. Bij een opticus glioom die beperkt is tot de oogzenuw zelf en waarbij het gezichtsvermogen nog goed is, zal chirurgie van de oogzenuw wellicht meer schade berokkenen dan de problemen verhelpen. Radiotherapie vormt in dat geval een goed alternatief. Met gefractioneerde stereotactische radiotherapie (nauwkeurige bestraling in porties) kan de tumor zeer precies bestraald worden, waarbij de normale hersenen en zenuwbanen niet beschadigd raken.
laatst bijgewerkt 9 september 2019
Pilocytair astrocytoom (graad 1)
Het pilocytair astrocytoom (graad 1) wordt ook wel het juveniel pilocytair astrocytoom genoemd omdat het vooral wordt gezien op de kinderleeftijd.
Symptomen
- Gedragsveranderingen of achteruitgang van de intelligentie
- Hoofdpijn
- Misselijkheid en braken
- Achteruitgang van het gezichtsvermogen
- Onzekere gang (wanneer de tumor in de kleine hersenen of hersenstam zit)
- Epileptische aanvallen (insulten)
Diagnose
Het pilocytair astrocytoom is een langzaam groeiende tumor. Het kan daarom soms lang duren voordat een tumor wordt vermoed bij een kind dat geleidelijk aan slechter gaat lopen of slechter gaat zien. Op een MRI is de tumor herkenbaar als een scherp begrensde tumor die veel contrastmiddel opneemt.
Behandeling
Chirurgie is de eerste keus van behandeling en aanvullende therapie is in het algemeen niet nodig. In het geval dat de tumor weer uitgroeit is chirurgie opnieuw de eerste keus van behandeling. Radiotherapie en chemotherapie worden alleen gegeven als chirurgie niet meer mogelijk of te gevaarlijk is, bijvoorbeeld bij een tumor in de hersenstam. Radiotherapie kan op jonge leeftijd de ontwikkeling van de hersenen ernstig verstoren. Bij zeer jonge kinderen zal daarom eerst met chemotherapie geprobeerd worden de groei van de tumor te remmen zodat de hersenen de kans krijgen om uit te rijpen.
laatst bijgewerkt 9 september 2019